| Mieloma
Attualità diagnostiche e strategie terapeutiche
del Dott. Tommaso Caravita, della Dott.ssa Giuseppina Natale e della Dott.ssa Agostina Siniscalchi
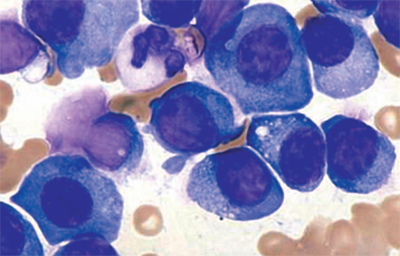 Il MIELOMAMULTIPLO [MM] è una neoplasia del
sistema linfoide B caratterizzata dalla presenza
di una componente monoclonale sierica
e/o urinaria, da un aumento delle plasmacellule
midollari, dalla formazione di lesioni
osteolitiche e dalla comparsa di anemia
ed ipercalcemia.
Il MM rappresenta l’1% di tutte le neoplasie
ed il 10% delle neoplasie ematologiche, colpisce
prevalentemente l’età medio-avanzata
[età mediana alla diagnosi 70 anni] con
una lieve predilezione per il sesso maschile
e per la razza nera, ha una incidenza complessiva
di 5.6 nuovi casi anno su 100.000
persone, variabile dall’2.9/100.000 per le
donne asiatiche al 14.4/100.000 per gli uomini
di razza nera. L’eziologia è tuttora sconosciuta,
anche se si ritiene un processo multifattoriale
alla cui insorgenza concorrono l’esistenza
di una predisposizione genetica e l’esposizione
ad agenti ambientali e virali.
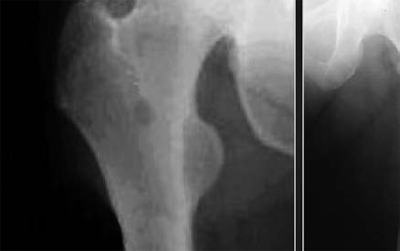
Le modalità di presentazione più frequenti
sono: anemia, lesioni osteolitiche e/o osteoporotiche,
sindrome ipercalcemica, insufficienza
renale acuta o cronica, infezioni, manifestazioni
neurologiche. L’analisi qualitativa
e quantitativa delle proteine sieriche ed
urinarie, lo studio del midollo emopoietico
e lo studio radiologico dello scheletro sono
gli strumenti diagnostici fondamentali a disposizione
del clinico.
La distinzione tra mieloma sintomatico, che
necessita di un trattamento e quello asintomatico,
che richiede invece solo un attento
monitoraggio, si basa sulla presenza di un
danno d’organo correlato alla malattia
[tab.1], in associazione alla presenza di una
componente monoclonale sierica >30 g/L e/o una plasmocitosi midollare >10%. Il MIELOMAMULTIPLO [MM] è una neoplasia del
sistema linfoide B caratterizzata dalla presenza
di una componente monoclonale sierica
e/o urinaria, da un aumento delle plasmacellule
midollari, dalla formazione di lesioni
osteolitiche e dalla comparsa di anemia
ed ipercalcemia.
Il MM rappresenta l’1% di tutte le neoplasie
ed il 10% delle neoplasie ematologiche, colpisce
prevalentemente l’età medio-avanzata
[età mediana alla diagnosi 70 anni] con
una lieve predilezione per il sesso maschile
e per la razza nera, ha una incidenza complessiva
di 5.6 nuovi casi anno su 100.000
persone, variabile dall’2.9/100.000 per le
donne asiatiche al 14.4/100.000 per gli uomini
di razza nera. L’eziologia è tuttora sconosciuta,
anche se si ritiene un processo multifattoriale
alla cui insorgenza concorrono l’esistenza
di una predisposizione genetica e l’esposizione
ad agenti ambientali e virali.
Le modalità di presentazione più frequenti
sono: anemia, lesioni osteolitiche e/o osteoporotiche,
sindrome ipercalcemica, insufficienza
renale acuta o cronica, infezioni, manifestazioni
neurologiche. L’analisi qualitativa
e quantitativa delle proteine sieriche ed
urinarie, lo studio del midollo emopoietico
e lo studio radiologico dello scheletro sono
gli strumenti diagnostici fondamentali a disposizione
del clinico.
La distinzione tra mieloma sintomatico, che
necessita di un trattamento e quello asintomatico,
che richiede invece solo un attento
monitoraggio, si basa sulla presenza di un
danno d’organo correlato alla malattia
[tab.1], in associazione alla presenza di una
componente monoclonale sierica >30 g/L e/o una plasmocitosi midollare >10%.
Tabella 1 - DANNO D’ORGANO CLASSIFICATO COME “CRAB” |
C |
Calcio sierico elevato > 10 mg/dl |
| R |
Disfunzione renale (creatinina > 2 mg/dl) |
| A |
Anemia (emoglobina < 10 g/dl o ridotta di 2 g rispetto valori soliti del paziente) |
| B |
Lesioni osteolitiche o osteoporosi |
| Altri |
Iperviscosità sintomatica, amiloidosi, infezioni batteriche ricorrenti (>2 episodi in 12 mesi) |
Tabella 2 - INTERNATIONAL STAGING SYSTEM |
I |
ß2-microglobulina (ß2M) <3.5 mg/L e albumina> 3.5 g/dl |
62 mesi |
| II |
ß2M <3.5 mg/L e albumina <3.5 g/dl; o ß2M 3.5-5.5 mg/L |
44 mesi |
| III |
ß2M> 5.5 mg/L |
29 mesi |
La stadiazione del MM, si avvale attualmente
di un nuovo criterio, l’INTERNATIONAL
STAGING SYSTEM [ISS], che affianca e completa
la tradizionale classificazione di Durie-
Salmon. [tab. 2].
Il MM è una malattia definita non eradicabile
e con una mediana di sopravvivenza di
2.5-3 anni per i pazienti trattati con terapia
convenzionale, che fino allo scorso millennio,
è stata rappresentata per il paziente non
eleggibile per una terapia ad alte dosi e trapianto
autologo di cellule staminali, dall’associazione
di agenti alchilanti e cortisone.
Negli ultimi decenni si è assistito ad un significativo
miglioramento nella gestione clinica
dei pazienti con MM, reso possibile dalle
crescenti acquisizioni diagnostiche e terapeutiche.
I risultati ottenuti con la terapia ad
alte dosi ed il successivo trapianto di cellule
staminali autologhe hanno permesso di aumentare
la percentuale non solo delle risposte
cliniche, ma anche dei lungo sopravviventi.
Inoltre, lo sviluppo delle terapie di
supporto, in particolare l’introduzione
dei fattori di crescita
[eritrocitari e granulocitari] e
dei bifosfonati, ha consentito un
netto miglioramento della qualità
di vita di questi pazienti.
Anche le procedure di trapianto
allogenico, che hanno comunque
un ruolo limitato nella terapia del
MM, grazie al recente impiego di
regimi di condizionamento ad intensità ridotta
hanno permesso di estendere il vantaggio
immunologico della “Graft Versus Myeloma”
ad un maggior numero di pazienti, riducendo
i rischi di mortalità precoce legati alla
procedura tradizionale. Comunque, queste
terapie rivestono ancora un ruolo sperimentale
e necessitano di un follow-up più lungo
per poter essere correttamente valutate.
Pertanto, in considerazione della ineluttabilità
della ripresa della malattia con le procedure
terapeutiche tradizionali, in questi ultimi
anni la ricerca si è sviluppata verso la
possibilità di identificare nuovi agenti terapeutici
in grado di superare i problemi della
chemioresistenza e ridurre la tossicità. La recente
scoperta di importanti informazioni
sulla biologia del mieloma multiplo ha permesso
di sviluppare strategie di trattamento
innovative per questa malattia, che resta tuttora
inguaribile, anche se attualmente curabile.
In particolare, si conoscono sempre meglio
sia i fini meccanismi molecolari intracellulari
che regolano la crescita cellulare, sia
le connessioni tra le cellule del mieloma ed
il microambiente midollare, oltre che il loro
ruolo nella progressione tumorale. Quindi,
numerosi studi sull’angiogenesi tumorale
hanno permesso di identificare una nuova
classe di farmaci con una spiccata attività anti-tumorale, di cui il capostipite può essere
considerato la Talidomide.
 Gli studi clinici effettuati hanno dimostrato
che la Talidomide è particolarmente attiva
nel trattamento del mieloma multiplo recidivato/
refrattario, sia in monoterapia che in
misura maggiore, in associazione con altri
farmaci come il desametazone. Gli effetti
collaterali di questa terapia sono risultati accettabili,
particolarmente in considerazione
della popolazione di pazienti su cui finora è
stato prevalentemente utilizzato. L’esigenza
di migliorare lo spettro d’azione ed il profilo
di tossicità della talidomide ha portato alla
formulazione ed alla sperimentazione degli
analoghi della talidomide. In particolare, la
lenalidomide mostra un’attività maggiore
con un profilo tossico differente, prevalentemente
rappresentato dalla tossicità ematologica,
mentre la neuropatia è rara. Le
trombosi venose profonde si osservano soprattutto
in terapie di associazione e l’impiego
di aspirina in profilassi, sembra ridurne
significativamente l’incidenza. Gli studi clinici effettuati hanno dimostrato
che la Talidomide è particolarmente attiva
nel trattamento del mieloma multiplo recidivato/
refrattario, sia in monoterapia che in
misura maggiore, in associazione con altri
farmaci come il desametazone. Gli effetti
collaterali di questa terapia sono risultati accettabili,
particolarmente in considerazione
della popolazione di pazienti su cui finora è
stato prevalentemente utilizzato. L’esigenza
di migliorare lo spettro d’azione ed il profilo
di tossicità della talidomide ha portato alla
formulazione ed alla sperimentazione degli
analoghi della talidomide. In particolare, la
lenalidomide mostra un’attività maggiore
con un profilo tossico differente, prevalentemente
rappresentato dalla tossicità ematologica,
mentre la neuropatia è rara. Le
trombosi venose profonde si osservano soprattutto
in terapie di associazione e l’impiego
di aspirina in profilassi, sembra ridurne
significativamente l’incidenza.
Bortezomib è il primo di una nuova classe di
farmaci chiamati inibitori del proteosoma ad
essere stato introdotto nella pratica clinica.
Il proteasoma è una complessa struttura presente
all’interno di ogni cellula, con la funzione
di degradare le proteine. La scoperta
dell’esistenza di questa ulteriore via di degradazione
delle proteine, oltre a quella dei
lisosomi, ha avuto un enorme significato
scientifico, tanto da meritare il Premio Nobel
per la Chimica 2004, e sembra costituire un
importante filone di ricerca clinica per il trattamento
di alcune neoplasie. L’inibizione del
proteosoma è già un importante opzione terapeutica
per i pazienti con Mieloma Multiplo
in ricaduta. Studi di fase II e fase III hanno
evidenziato l’efficacia di questo farmaco
nel MM recidivato/refrattario, permettendone
l’approvazione da parte delle autorità
sanitarie americane ed europee. L’impiego
di questi nuovi farmaci è attualmente in fase
di sperimentazione anche nei pazienti
giovani candidati a trapianto autologo di cellule
emopoietiche raccolte da sangue periferico.
Infatti, questi farmaci non impattano
negativamente sulla raccolta delle cellule
staminali e possono essere quindi utilizzati
nella fase di induzione, oltre che nelle fasi di
consolidamento post-autotrapianto, da soli
o in associazione con altri agenti. I dati preliminari
disponibili hanno dimostrato l’efficacia
di questi farmaci, da soli od in associazione,
permettendo un incremento delle
risposte, della loro qualità e della sopravvivenza
libera da malattia.
In conclusione, l’introduzione dei nuovi farmaci
sta modificando in maniera sostanziale
la gestione del paziente con mieloma multiplo
ed in particolare dei pazienti anziani.
Infatti, sono attualmente disponibili per pazienti
non candidabili al trapianto diverse
opzioni terapeutiche, che impiegano “nuovi
farmaci” in associazione alla chemioterapia
ottenendo risultati comparabili a quelli
ottenibili con l’autotrapianto. |
![]()




 Il MIELOMAMULTIPLO [MM] è una neoplasia del
sistema linfoide B caratterizzata dalla presenza
di una componente monoclonale sierica
e/o urinaria, da un aumento delle plasmacellule
midollari, dalla formazione di lesioni
osteolitiche e dalla comparsa di anemia
ed ipercalcemia.
Il MM rappresenta l’1% di tutte le neoplasie
ed il 10% delle neoplasie ematologiche, colpisce
prevalentemente l’età medio-avanzata
[età mediana alla diagnosi 70 anni] con
una lieve predilezione per il sesso maschile
e per la razza nera, ha una incidenza complessiva
di 5.6 nuovi casi anno su 100.000
persone, variabile dall’2.9/100.000 per le
donne asiatiche al 14.4/100.000 per gli uomini
di razza nera. L’eziologia è tuttora sconosciuta,
anche se si ritiene un processo multifattoriale
alla cui insorgenza concorrono l’esistenza
di una predisposizione genetica e l’esposizione
ad agenti ambientali e virali.
Le modalità di presentazione più frequenti
sono: anemia, lesioni osteolitiche e/o osteoporotiche,
sindrome ipercalcemica, insufficienza
renale acuta o cronica, infezioni, manifestazioni
neurologiche. L’analisi qualitativa
e quantitativa delle proteine sieriche ed
urinarie, lo studio del midollo emopoietico
e lo studio radiologico dello scheletro sono
gli strumenti diagnostici fondamentali a disposizione
del clinico.
La distinzione tra mieloma sintomatico, che
necessita di un trattamento e quello asintomatico,
che richiede invece solo un attento
monitoraggio, si basa sulla presenza di un
danno d’organo correlato alla malattia
[tab.1], in associazione alla presenza di una
componente monoclonale sierica >30 g/L e/o una plasmocitosi midollare >10%.
Il MIELOMAMULTIPLO [MM] è una neoplasia del
sistema linfoide B caratterizzata dalla presenza
di una componente monoclonale sierica
e/o urinaria, da un aumento delle plasmacellule
midollari, dalla formazione di lesioni
osteolitiche e dalla comparsa di anemia
ed ipercalcemia.
Il MM rappresenta l’1% di tutte le neoplasie
ed il 10% delle neoplasie ematologiche, colpisce
prevalentemente l’età medio-avanzata
[età mediana alla diagnosi 70 anni] con
una lieve predilezione per il sesso maschile
e per la razza nera, ha una incidenza complessiva
di 5.6 nuovi casi anno su 100.000
persone, variabile dall’2.9/100.000 per le
donne asiatiche al 14.4/100.000 per gli uomini
di razza nera. L’eziologia è tuttora sconosciuta,
anche se si ritiene un processo multifattoriale
alla cui insorgenza concorrono l’esistenza
di una predisposizione genetica e l’esposizione
ad agenti ambientali e virali.
Le modalità di presentazione più frequenti
sono: anemia, lesioni osteolitiche e/o osteoporotiche,
sindrome ipercalcemica, insufficienza
renale acuta o cronica, infezioni, manifestazioni
neurologiche. L’analisi qualitativa
e quantitativa delle proteine sieriche ed
urinarie, lo studio del midollo emopoietico
e lo studio radiologico dello scheletro sono
gli strumenti diagnostici fondamentali a disposizione
del clinico.
La distinzione tra mieloma sintomatico, che
necessita di un trattamento e quello asintomatico,
che richiede invece solo un attento
monitoraggio, si basa sulla presenza di un
danno d’organo correlato alla malattia
[tab.1], in associazione alla presenza di una
componente monoclonale sierica >30 g/L e/o una plasmocitosi midollare >10%. Gli studi clinici effettuati hanno dimostrato
che la Talidomide è particolarmente attiva
nel trattamento del mieloma multiplo recidivato/
refrattario, sia in monoterapia che in
misura maggiore, in associazione con altri
farmaci come il desametazone. Gli effetti
collaterali di questa terapia sono risultati accettabili,
particolarmente in considerazione
della popolazione di pazienti su cui finora è
stato prevalentemente utilizzato. L’esigenza
di migliorare lo spettro d’azione ed il profilo
di tossicità della talidomide ha portato alla
formulazione ed alla sperimentazione degli
analoghi della talidomide. In particolare, la
lenalidomide mostra un’attività maggiore
con un profilo tossico differente, prevalentemente
rappresentato dalla tossicità ematologica,
mentre la neuropatia è rara. Le
trombosi venose profonde si osservano soprattutto
in terapie di associazione e l’impiego
di aspirina in profilassi, sembra ridurne
significativamente l’incidenza.
Gli studi clinici effettuati hanno dimostrato
che la Talidomide è particolarmente attiva
nel trattamento del mieloma multiplo recidivato/
refrattario, sia in monoterapia che in
misura maggiore, in associazione con altri
farmaci come il desametazone. Gli effetti
collaterali di questa terapia sono risultati accettabili,
particolarmente in considerazione
della popolazione di pazienti su cui finora è
stato prevalentemente utilizzato. L’esigenza
di migliorare lo spettro d’azione ed il profilo
di tossicità della talidomide ha portato alla
formulazione ed alla sperimentazione degli
analoghi della talidomide. In particolare, la
lenalidomide mostra un’attività maggiore
con un profilo tossico differente, prevalentemente
rappresentato dalla tossicità ematologica,
mentre la neuropatia è rara. Le
trombosi venose profonde si osservano soprattutto
in terapie di associazione e l’impiego
di aspirina in profilassi, sembra ridurne
significativamente l’incidenza.